| 研發人員要從零開始工作。他們必須找出所有相關的材料,對所有必要的程序進行驗證,並要進行關鍵於產品「首次」獲批上市的多種研究項目(包括臨牀前和臨牀研究)。 |
|
仿製藥製造商,可節省開發的成本,因汲取了前人的製藥經驗;不必「重做」一些原研發者投入了很多時間金錢,且是繁瑣的研究工作。
|
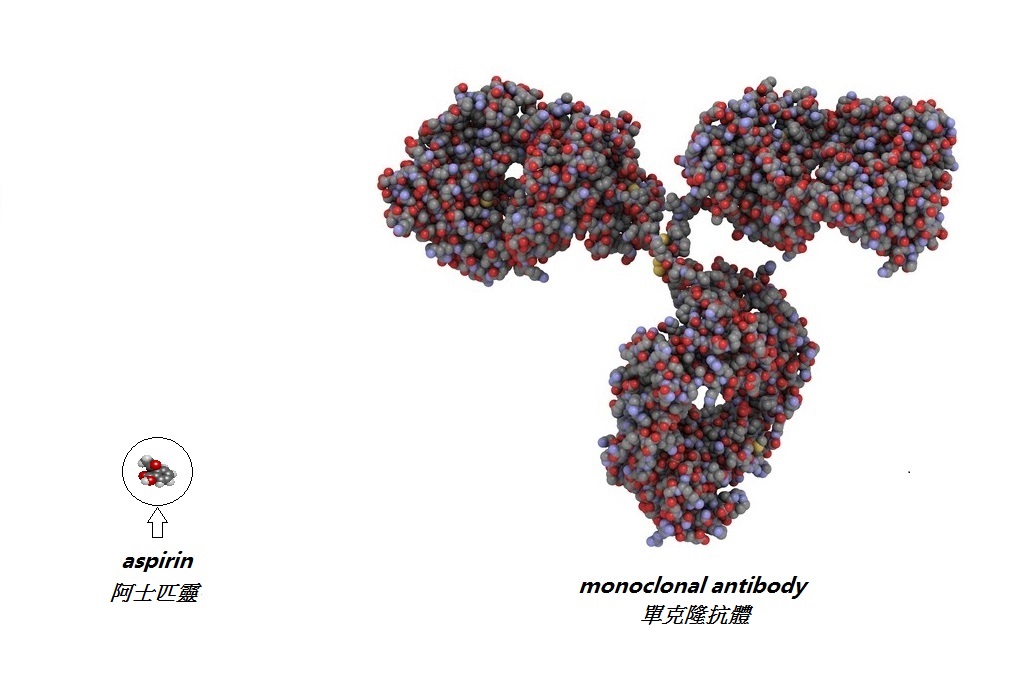
| 但是複製生物產品,仍需要多方面的專門技術和保證品質安排。生產的原材料有嚴謹且特殊的要求(例如,所採用的細胞品種來源專屬);另外生產過程亦會受到生產條件輕微變化(例如溫度、配方和容器物料)所影響。原材料與生產的條件儘管只有細小的變化,也能對最終的產品造成大改變。因此,為了確保所生產的生物製品(不論是原研發藥或生物相類似藥)的質量能夠保持平均與一致,須實施嚴格的質量監控。 |
|
事實上,即使在原研發者的廠房內,並且已嚴謹地遵守生產標準,生物製品仍會出現一些自然的差異。而原研發者一般也會制定些「標準」測試,以保證所製造出來的產品,能擁有一些發揮功效的重要特性。於產品內,存在著的細小變異的情況,在專業術語稱之為「微觀異質性」。
|
 |
| |
| 因此,負責仿製的廠商的目標就是,要把「生物相類似藥」和「原研發藥」的差異減至最低。它會以原研發者的生產和檢測方法為藍本,務求使仿製的產品與原創的產品有很大程度上相「近似」。 |
| |
| 高靈敏度的動物和人體測試(即:一些比對研究),一般都可採納用於偵測原研發藥與「生物相類似藥」之間有甚麼少許的差別。換句話說,這就是要排除該兩種產品之間於臨牀療效和安全性,會有顯著差異的可能。 |
| |
| 有時,供參照的原創產品可能會有多於一項的適應症(「適應症」是指:標示於藥品內,注明該產品可適應於及可治療於一些疾病或症狀的項目)。那麼,如果臨牀的比對研究(人體測試)能夠證明該生物相類似藥,在「已研究的」某一適應症的範疇與與參照品的療效「相類似」的話;則就可以預期該生物相類似藥(但須個別個案考慮)也能獲准用作,該參照品已獲批准的其他適應症。把生物相類似藥附加上適應症,專業術語上常簡稱為「外推」(即:向外推算演繹藥品的應用範圍)。 |
|